以“聚焦源头创新,开拓新药新格局”为主题的第八届百奥赛图模式动物与医药产业大会于2022年7月2日线上成功举办!一年一度的百奥赛图模式动物与医药产业大会已经于线下成功举办了七届,今年由于疫情的原因,会议调整为线上举办。参会形式改变,学术交流初心不变。本届大会共邀请到20余位嘉宾进行了精彩的分享,大会沿袭了过往优良传统,持续营造高质量学术氛围,得到了大家的一致好评。大会当日直播平台累计观看超11,000+人次,合作平台观看2,000+人次。
大会在海门东布洲科学小城短片和徐骏书记致辞中拉开帷幕。紧接着,百奥赛图董事长兼总经理沈月雷博士进行开幕致辞并宣布大会正式开始!
大会报告嘉宾围绕新靶点及下一代细胞治疗疗法、基于抗体的新药物形式如何发展、新概念、新技术和新方法将如何助力临床需求的满足等话题展开分享和交流。

来自暨南大学生物医学转化研究院的教授、院长、博士研究生导师尹芝南博士作了题为《IL-27:治疗肥胖和脂肪肝新靶点》的精彩报告。尹教授阐明了IL-27除了免疫学功能外,还可以通过p38MAPK-PGC1a信号通路促进脂肪细胞产热,从而避免高脂饮食诱导的肥胖和胰岛素抵抗。此项成果发表在了2021年11月的Nature期刊。此外,尹教授还介绍了IL-27对脂肪肝和神经退行性疾病的治疗潜力。

来自中山大学肿瘤防治中心、华南肿瘤学国家重点实验室的教授、博士生导师,广州泛恩生物科技有限公司的创始人周鹏辉博士作了题为《个体化TCR-T细胞治疗的建立与应用》的精彩报告。周教授指出,病人自身产生的识别肿瘤的T细胞具有良好的安全性和多样性,通过实验分析发现,CXCl13是一个优异的marker,可以将体内肿瘤特异性T细胞(Tas)准确鉴定出来。获得Tas的TCR后,导入患者外周血来源的T细胞,在体外制备成多克隆TCR-T细胞,靶向多个肿瘤新抗原,回输后,达到治疗肿瘤的目的。这个项目也是目前第一个进入临床的个性化TCR-T细胞疗法。

来自星奕昂(上海)生物科技有限公司的CMC副总裁宗鸿亮博士作了题为《下一代肿瘤细胞治疗产品iPSC-CAR-NK》的精彩报告。宗博士指出,相比于CAR-T,CAR-NK可能是更好的靶向实体瘤的通用型细胞治疗药物。而iPSC是具有优势的通用型细胞生产原料:方便多基因编辑、可建库,易于量产化,便于质控,可显著降低生产和治疗成本。头部企业的初步临床研究已证明了iPSC来源的CAR-NK安全、有效。但iPSC-CAR-NK的工艺还有待进一步优化,临床的安全性和有效性也有待更多iPSC-CAR-NK产品数据来支持。
Panel1:新靶点与下一代细胞治疗路在何方
三位嘉宾精彩的报告结束后,由浙江大学医学院研究员张进教授主持,就热点问题和观众朋友们的提问,与三位嘉宾针对新靶点与下一代细胞治疗路在何方进行了一场热烈的讨论。
尹芝南博士
Q:IL-27与现有的治疗肥胖的药物相比有哪些特点和优势呢?
A:目前批准的单纯治疗肥胖的药物主要还是GLP-1激动剂,它们主要通过控制食欲来减肥。但IL-27是通过脂肪燃烧来减肥,是一种全新的机制,可能会与现有药物形成互补。
Q:那么目前有没有直接靶向产热的药物,比如靶向UCP-1的?
A:据我们了解,目前只有处于临床前的,还没有临床阶段的。
Q:IL-27是免疫细胞因子,将其用于减肥的时候,会不会有炎性反应和安全性的问题?
A:目前我们在动物试验中,用重组蛋白短期内没有发现安全性的问题。高脂饮食饲喂后,IL-27R在免疫细胞表达得少,而在脂肪细胞高表达。今后,我们会希望以mRNA的形式将IL-27靶向递送至脂肪细胞,进一步减少毒副作用。
Q:IL-35和IL-27共用EBI-3亚基,是同一家族的细胞因子,那么IL-35是否也有类似的减肥的作用呢?
A:我们确实看到肥胖病人的血清中,IL-35下降,并且比IL-27下降还多,但是因为没有相应的基因编辑工具小鼠,我们目前还没有研究。我们观察到敲除EBI-3可使小鼠肥胖,我们认为是IL-27的作用,但是也不能排除IL-35的作用。
周鹏辉博士
Q:如何判断哪些病人适合TCR-T治疗?
A:传统的TCR-T细胞治疗使用单个TCR,对应单一的靶抗原,患者在表达该靶抗原的同时,还必须表达该TCR所对应的HLA亚型,适用人群小。我们的个性化TCR-T技术,直接从患者体内获得识别肿瘤抗原的TCR,而约80%患者都存在肿瘤抗原特异T细胞,所以大部分实体肿瘤患者都适用我们的个性化TCR-T细胞治疗。
Q:所有的肿瘤细胞突变都能被提呈吗?
A:我们发现只有约20%的突变基因能够被有效呈递。这也是导致目前新生抗原疫苗的有效率不高的一个重要原因,所使用的抗原肽不能有效激活免疫反应。抗原被呈递需要满足多个条件,首先需要要能表达成蛋白,且一般情况下表达量还不能太低,与HLA的亲和力要足够高才能装载到HLA分子上。另外患者体内必须有能够识别这个抗原的T细胞,才能激活相应的免疫反应。突变的抗原没有经过胸腺中的阴性选择,被T细胞识别的概率要更高一些,但同样需要满足以上的这些条件才能够成为肿瘤抗原。
Q:您发现CXCl13是肿瘤特异性T细胞的marker,它的生物学机制是怎样的?
A:CXCl13是一种趋化因子,它的受体是CXCR5。CXCR5在B细胞,DC细胞,CD4+ T细胞和CD8+ T细胞上都有表达。当T细胞识别肿瘤后,可以通过分泌CXCl13来招募其他类型的免疫细胞,来协助增强抗肿瘤免疫反应。当这些细胞聚集到一起,会进一步形成三级淋巴结构,成为免疫细胞攻击肿瘤细胞的据点,进一步提高抗肿瘤免疫反应。
宗鸿亮博士
Q:iPSC来源的与原代来源的CAR-NK相比有什么优势?
A:原代来源的生产能力相对较低,而且基因编辑也是原代细胞产品工艺中一个重要的产量限制因素,并且难以形成CAR的均一性表达。而iPSC来源的,可以进行序贯多基因编辑,也就是在每步基因编辑后挑选阳性克隆建库后,再编辑下一个或几个基因。由于是克隆化的细胞,在CAR表达方面可以保证终产品是100%表达CAR的。
Q:CAR-NK和CAR-T相比怎样?
A:CAR的部分在很多研究中其实没有本质的区别。但NK具有广谱的杀伤作用。对于HLA表达异常的肿瘤细胞,T细胞无法识别,但NK细胞可以杀伤。CAR-NK也可以和抗体联用。因此CAR-NK可能通过上述多种机制,发挥比CAR-T更好的抗实体肿瘤效果。
Q:CAR-NK的分化和扩增需要辅助细胞的参与吗?
A:业内在分化过程中有的团队会使用辅助细胞,比如基质细胞(stroma cells)可以提呈配体,分泌细胞因子;扩增的过程中会使用肿瘤细胞作为滋养细胞,促进NK细胞激活、增殖。但使用辅助细胞需要注意的是细胞的交叉污染,和残留包括其降解成分的安全性评估。一般都要先去除辅助细胞的增殖能力,比如辐照K562细胞。理想的做法是在弄清楚滋养细胞激活NK细胞扩增的机制后,使用合适的重组蛋白,使得工艺过程更加安全。
对三位嘉宾分别提问后,张进老师又问出了大家所关心的共性问题。
Q:在临床转化的过程中,您几位都有怎样的经验可以分享给观众?
尹老师:经验谈不上,但教训很多。大学教授想将成果转化,需要依赖资本,需要职业管理经验,或者说找到有管理经验的合伙人。同时要和大学理清知识产权的关系。跟资本对接,不要有对赌条款。
周老师:成果转化,需要多跟临床接触,了解什么是临床迫切需要解决的问题,再用我们的基础研究去解决。临床的难点就是我们的机会。无论是开发药物,建立诊断方法,还是辅助治疗都很有价值。转化还需要多方的合作,包括药品临床试验,工业制备与生产,项目管理等专业团队的合作等。
宗博士:临床转化过程中,监管部门最关心的就是产品安全性,工艺合规性(物料GMP等级,过程可追溯性)和质量稳定性。像iPSC来源的CAR-NK,就会考察干性细胞的致瘤性。基础研究对我们来说是很重要的,比如NK细胞的分化策略和基因改造增强策略都是随着最新的研究而不断优化。总的来说就是要与监管部门积极沟通,打消他们的顾虑。

乐普生物研发副总裁/乐普创一总经理 方磊博士进行了题为《T cell engager design and development》的报告。肿瘤免疫治疗有效率有限,如何从cold到hot tumor是未来肿瘤免疫治疗的方向,其中一个重要手段是T cell engager,能够改善免疫微环境,较两个抗体药物联用更有优势。T cell engager目标是模拟人的免疫突触,要考虑engager和TAA的结构和距离,尽量拉大治疗窗口。另外还有CD3 potency问题,要找到有效杀伤和安全性平衡的点。除了CD3 signal,增加其他共刺激信号组成三抗等进行优化的结构设计也是将来的方向。T cell engager在设计中其potency和valance,杀伤、细胞因子产生和T细胞激活,药物成药性都是非常关键的考量因素。
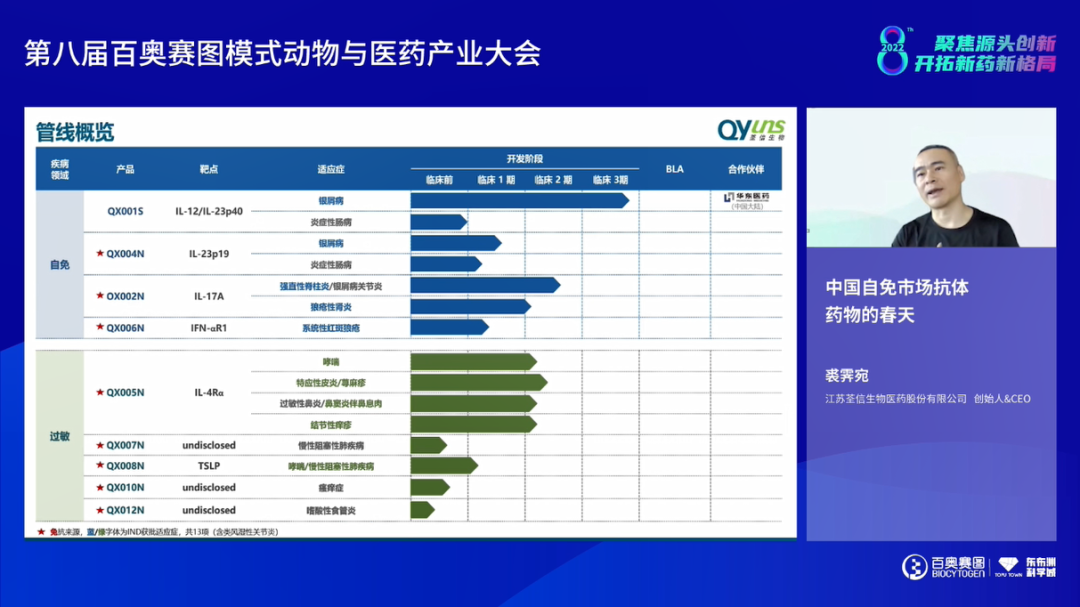
来自荃信生物的创始人&CEO裘霁宛先生为大家分享了《中国自免市场抗体药物的春天》。从支付、产品、诊疗及患者4个端口来看,中国属于自免药物市场的春天即将到来,特别是产品端的研发如火如荼,如TNF-α抑制剂和针对Th17通路及Th2通路均有相当数量的产品在研或上市;支付端的大力倾斜,如近3年自免领域有14个产品进入医保,未来5-10年将会是行业发展黄金期。荃信生物专注自免领域解决方案,开展针对皮肤、呼吸、消化、风湿等多适应症的产品开发,其中,QX001S处于临床III期阶段,将与华东医药合作推向商业化;差异化IL-17A单抗QX002N和IL-4Rα单抗QX005N的1、2期临床结果显示良好的安全性和有效性。当前,自免产品开发仍存在基础研究相对落后、临床前模型缺乏和临床试验挑战多等问题,亟待大家共同解决。

来自百奥赛图的抗体新药研究院首席科学官杨毅博士为大家介绍了《双靶点和双表位ADC药物的筛选和临床需求》。ADC药物发展迅猛,DS-8201大获成功,ADC药物还是有可以优化的空间。双抗ADC可以提高肿瘤选择性和內吞效率,进一步杀伤肿瘤。其中靶点选择、內吞效率、药物稳定性都是关键考量因素。百奥赛图基于共轻链小鼠RenLite平台开发出的YH012是一款靶向HER2×TROP2的双抗ADC,显示出良好的抗体稳定性和理化性质,体内临床前研究体现出更强和持续的抗肿瘤作用。使用RenLite小鼠也可以构建获得內吞性质更好的双表位ADC分子。百奥赛图正在针对200-300多个TAA靶点规模化开发一系列的双抗ADC药物。

来自映恩生物的药物研发副总裁花海清博士进行了题目为《The Era Post DS8201:机遇与挑战》的报告。DS-8201后时代如何设计下一代ADC产品呢?从抗体、Linker及Payload都有进一步改进的空间,如发现新靶点如CDH6、新的抗体形式和功能、提升Payload安全性、使用新型的毒素或免疫调节剂、双payload方式等。映恩生物建立了新一代ADC平台:三代DITAC平台、自身免疫的DIMAC平台、基于免疫激动剂的DISAC平台以及双特异性ADC和多payload ADC。映恩生物Her2-ADC DB-1303与Trop2-ADC DB-1305产品均有更好的肿瘤抑制效果。ADC还可以与IO疗法、DDR抑制剂和靶向治疗联用,拓展更多的患者人群。DS-8201后时代不是结束,只是一个开始,有更多方向还等待大家去探索。
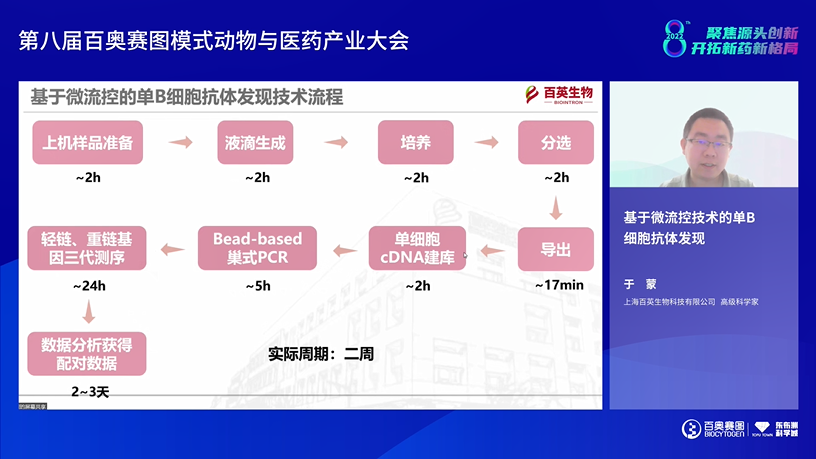
来自百英生物的高级科学家于蒙博士介绍了《基于微流控技术的单B细胞抗体发现》。单B细胞筛选技术包括流式细胞术能够分离抗原特异性的MBC,纳米孔筛选技术既适合浆细胞又适合MBC的筛选,另外还有光电定位技术更加精准和自动化。百英生物正在开发基于微流控的单B细胞抗体发现技术,从富集浆细胞到获得抗体序列筛选周期约两周时间。于博士详细介绍了样品准备、液滴生成、单细胞培养、分选及导出等的过程,再经过单细胞cDNA建库和免疫球蛋白基因扩增,获得序列数据在进一步分析获得有效数据。
Panel2:未来,基于抗体的创新疗法将如何发展
接下来邀请到百奥赛图抗体研究院杨勇飞博士作为主持,就未来,基于抗体的创新疗法将如何发展的热点问题及评论区观众提问与嘉宾进行互动交流。
Q:ADC进来发展非常火热,请几位谈一下ADC发展是否达到了比较高的高度,未来是否能够通过发展进一步提高ADC药物的治疗窗口?
A:肖亮博士(肖博):没有最好,只有更好,技术也是如此。ADC技术总会有不断的革新换代,永远可以优化安全窗,在已有基础上进一步提高和突破。最近ADC DS-8201的刷屏,还是需要有不断优化的地方,提高药物治疗疗效和安全性。
花海清博士(花博):药物对患者来讲,就是有效性和安全性。在这个方面有很多可以做的工作,ADC药物可以更加精准、更加安全、更加有效,payload部分可以通过化学的改造和机制的应用带来新的生物学机制,给患者带来更好的治疗空间。作为抗肿瘤的ADC药物,最终都会面临耐药的问题,下一代ADC技术有很大开发空间。
Q:抗体、Linker、Payload未来改进哪个更有机会突破?
A:花博:三个都有,payload对于ADC是最重要的,开发新的毒素或新机制的小分子;抗体也可以有突破的空间,比如双抗ADC,提高精准性和多功能性;Linker的改进增强产品的成药性和生产方便的便利性。
Q:提到ADC药物有耐药问题,方磊总也介绍了T cell engager方向的talk,介绍了基于CD3三特异性抗体有很不错的效果,那么engager是否可以尝试与ADC联用,解决ADC耐药问题?
A:方磊博士(方博):从乐普生物内部的数据来看,MMAE base的ADC药物和PD-1之间不管从临床还是临床前联用效果是很好的。ADC本身可以诱导immunogenic cell death,PD-1类药物起效比较慢,需要先激活免疫系统来控制肿瘤进展,进展快的肿瘤如三阴性乳腺癌或者转移性小细胞肺癌免疫治疗的起效效果比较慢,可以用ADC救急,加上免疫治疗逐渐恢复免疫系统。ADC和免疫治疗可以更好的结合起来,不仅可以控制肿瘤增殖,还可以控制细胞因子风暴。随着研究技术的成熟,单个药物的成本已经逐渐下降,步入治疗深水区。更安全的ADC可以更有效替代化疗,最终和免疫治疗或T cell engager、PD-1联合,非常期待。
Q:Engager多数是基于T细胞的, NK engager有什么独特优势吗?哪个靶点您认为是最合适的?
A:方博:NK engager我们也在进行研究,T cell和NK细胞都是专业杀伤肿瘤的免疫细胞,NK 细胞是第一道防线,T细胞是终极杀手。但是NK 细胞和T细胞本身不冲突,更多跟靶器官相关,有的器官耐受性较差,肠胃器官的肿瘤例如用claudin18.2 CAR-T和 claudin 18.2 ADC效果好且可耐受剂量较高,但比如肝脏本身是免疫耐受的环境,过度T 细胞激活可能会引起肝炎和肝纤维化等炎性反应,这类的采用NK 细胞治疗可能会获得更好的效果。在人体比较重要的其他器官未来可能是贯序的治疗,在肿瘤发生的更早阶段,启动天然免疫,NK细胞分泌大量细胞因子募集其他免疫细胞,再进行T细胞 engager的治疗方式。未来不同的治疗手段都会有发挥的空间,例如更安全的ADC可以推到一线,用小剂量的ADC做priming,结合其他的免疫疗法进行联合治疗和维持治疗,给医生和患者更多的治疗组合选择。
Q:现在新的技术还在不断发展,基于抗体,偶联药物变成ADC,偶联核素变成ARC,偶联Oligo变成AOC,有各种新的形式出现,请各位嘉宾谈谈自己的看法。
A:肖博:各种新的尝试组合业界称为XDC,是一个很新很好的概念,radio labeled已有药物了,核酸等新modailty 偶联相信会有比较的好的前景。但从提出概念到第一个药物上市,还是需要很多时间来摸索技术,选择靶点,适应症,合理的生物学机制,通过临床前和临床证实概念。除了保证疗效还要注意安全性,很多疾病的耐受并不像肿瘤病人对副作用耐受比较高,自免或者精神类疾病的治疗门槛还比较高,但相信总有技术可以实现。
花博:药物形式能解决临床需求解决应用场景。ARC有成功案例,比如脑瘤对放射敏感,对安全性耐受bar比较低,对抗体和linker的要求不一样,也是一项逐渐成熟的技术;多肽的偶联也有成功的案例。像ADC早年的研发,概念没有被验证,安全性怎么样等都有很多问题。对核酸类药物最大的问题就是递送,对于肝脏靶点有很好的效果,但是肝脏之外的靶向性有待提升。挑战也仍然存在,核酸类药物的递送、应用场景能否找到突破口,有待于在临床前完成验证再推进至临床。
Q:不管是ADC还是CAR-T,Engager药物都是基于肿瘤的marker为基础进行的方法尝试?方总您认为在不同成药形式里,哪种更有独特优势和面临哪些挑战呢?
A:方博:大家都在经常比较CAR-T和engager,这两类其实并不矛盾,强生和罗氏有两款针对BCMA和CD3,当然同时也有靶向BCMA 的CAR-T,可以看到这两款engager的临床治疗效果很好,惠及的病人有很多,但是它们在CAR-T耐药的病人效果并不是很好。CAR-T治疗效果很惊艳,但是对病人要求很高,需要病人清淋,以及病人是否耐受,病人T细胞是否合适制备CAR,是个体化治疗和通用性治疗的不同方向。未来包括引入第二信号来制备三抗,如加入CD28,通过抗体药物实现更多的普及性。我相信在人类完全了解细胞且细胞可控的情况下,未来会是细胞治疗的天下。
Q:如何看点医药行业低潮,对生物制药发展有什么影响,有些biopharma已经开始做CDMO了,您认为接下来中国的biotech、biopharma及成熟的bigpharma,未来发展趋势是什么?
A:肖博:任何行业/时代发展总是起起伏伏。一个技术终归有自己的生命周期,在下一个发展浪潮来临前,肯定需要经过各种整合,经过把泡沫除清的过程,如果没有这个过程行业一定是不健康的。您提到的有的公司做CDMO,可能主要由于产能过量,必须释放产能,产能释放后会进一步促进行业新的发展,生产成本可能会降低,往前端做创新的尝试可能会更大胆。CMC成本下降了,但是猴子价格上升了,所以行业还是需要进一步除清和洗牌,包括临床前的CRO。最终才能达到让创新不再因为它的生产制造及评价成为瓶颈,从全球角度讲创新会进入新的历史发展速度。当然新的技术和方向也会面临同样的问题,是循环往复的过程,会给病人带来更多好的治疗方案。二级市场来看已经回暖,长远看还需要1-2年时间调整和除清,带来更健康的行业发展。
方磊博士
Q:现在有没有可能在ADC上偶联两种分子,一种是激动剂激活免疫系统,另一端偶联毒素,两个同时加入是否可以产生协同效应?
A:如果作为研究,我自己可能不会选择放在一起,几个药物的贯序治疗,如果联合治疗剂量还可以相应调整;但如果做成一个分子,那会改变分子的理化性质和PK;变成ADC后可能更疏水,ADC PK会非常复杂。有可能不能两面兼顾。为了免疫治疗的ADC,如果基于基质细胞的,目标不是杀死肿瘤,可以降低payload DAR值,可以与更多的免疫治疗联用,比如在更早期的新辅助治疗联用。
Q:三价抗体和双价比在CMC工艺上难多少?
A:看什么结构,对称结构比非对称结构更容易,非对称结构CMC发展通过KIH也比较容易。对每一个compound三个arm的抗体都要筛选好,并且筛选足够的backup。同样的理化性质同样的亲和力类似的表位更有diverse才能选出更好的组合,同时也需要做很多尝试,没有一个format通吃的通用办法。另外在分子设计过程中也要注意分子量,超过150KD或200KD的药物PK 会清除的更快,尽可能接近150KD或者纳米抗体也是很好的方向,关键是筛选、备份、尝试,选出最好的Hits进行测试。
Q:T cell engager结构设计上除了考量靶点的空间距离,亲和力怎么考量?
A:一般设计target 肿瘤抗原部分的亲和力要比target engager的部分至少高10倍以上,亲和力高的一端同样血药浓度下更希望是强的一端。FDA有专门的guidance表明需要清晰阐述分子哪边的亲和力更高。
Q:有什么方法可以测定engager的空间距离吗?
A:主要是基于扫描电镜、冷冻电镜和已经发表的数据。随着AI技术的快速发展,结构预测会更容易,免疫球蛋白的折叠还是非常有规律的。其实我分享的距离不是真实意义的距离,是一个先验性的结果,效果好再返回去看原因,最终还是实验验证的结果,将来加上AI的合理预测可能会更好的指导未来的抗体设计。
花海清博士
Q:您如何看待ADC治疗中的光免疫疗法?
A:这个是免疫治疗比较小众的领域,涉及技术及应用场景,光调节的payload涉及光的穿透性,不是所有肿瘤都适用,很多还是在头颈部肿瘤,对光照穿透性比较好的场景下,会有比较好的效果。优势是安全性比较可控,可以通过外部的调节达到治疗效果,多了安全性的保护。也是一个非常有意思的领域。
Q:DB1303 和DS-8201相比有哪些优势?
A:DB1303除了已经展示的血浆稳定性更好外,其更大的优势在安全性上,DS-8201的ILD是很大的风险,有不可逆的毒性;DB1303临床前没有看到有ILD风险,目前临床也正在顺利进行中没有发现ILD风险。HER2靶点的有效性不是很担忧,在DS8201之后安全性的提升是很重要的,我们希望获得更安全的3代HER2-ADC产品。
Q:自免ADC有哪些比较好的进展,有什么特殊优势?
A:首先,自免ADC对抗体的要求更高,选择的抗体具有很强的抗炎的作用,对自免通路的验证性是比较高的,在抗体基础上加上高活的小分子抑制剂,可以获得更强更广泛的针对自免疾病的治疗。另外,应用场景主要针对一线生物制剂和抗体制剂耐药的患者,或者一些比较难治的疾病例如红斑狼疮目前没有很好的治疗药物,很多生物制剂的有效性其实是一个boarder line,有非常marginal的效果。患者需要强效的生物制剂,自免疾病通常发病比较复杂,自免ADC的优势在于Payload药效的广泛性,很多糖皮质激素等药物都是有验证性的效果的,但本身激素的系统治疗副作用比较大,很多患者不耐受长期的激素治疗,自免ADC发挥了两方面的优势和克服了缺点。
Q:请您介绍下实时內吞的检测技术?
A:內吞有很多检测方法,传统的残余受体检测方法:根据膜表面受体量的减少推测內吞,是间接检测法;直接法,可以将抗体做些标记,检测从进入到內吞,通常是通过FACS分析或者拍照的方式记录。杨毅博士报告提到了双抗ADC筛选双抗內吞检测方法,采用了Incucyte技术,属于拍照类的方法,是实时的监控,不断积累细胞內吞的数据,获得內吞的完整体现,但是需要对设备有一定要求。












 京公网安备:
京公网安备: